TNBC

KEYTRUDA® está indicado para el tratamiento de pacientes con cáncer de mama triple negativo (TNBC) en estadio temprano de alto riesgo en combinación con quimioterapia como tratamiento neoadyuvante, y luego continuado como monoterapia como tratamiento adyuvante después de la cirugía.1

- A los 24 meses, la supervivencia libre de eventosa,b (EFS) estimada fue de 87.8% (IC del 95%, 85.3–89.9) en el grupo de KEYTRUDA + quimioterapiac/KEYTRUDA vs. 81.0% (IC del 95%, 76.8–84.6) en el grupo de placebo + quimioterapiac/placebo.1
- A los 36 meses, la supervivencia libre de eventos estimadaa fue de 84.5% (IC del 95%, 81.7–86.9) en el grupo de KEYTRUDA + quimioterapiac/KEYTRUDA vs. 76.8% (IC del 95%, 72.2–80.7) en el grupo de placebo + quimioterapiac/placebo.2
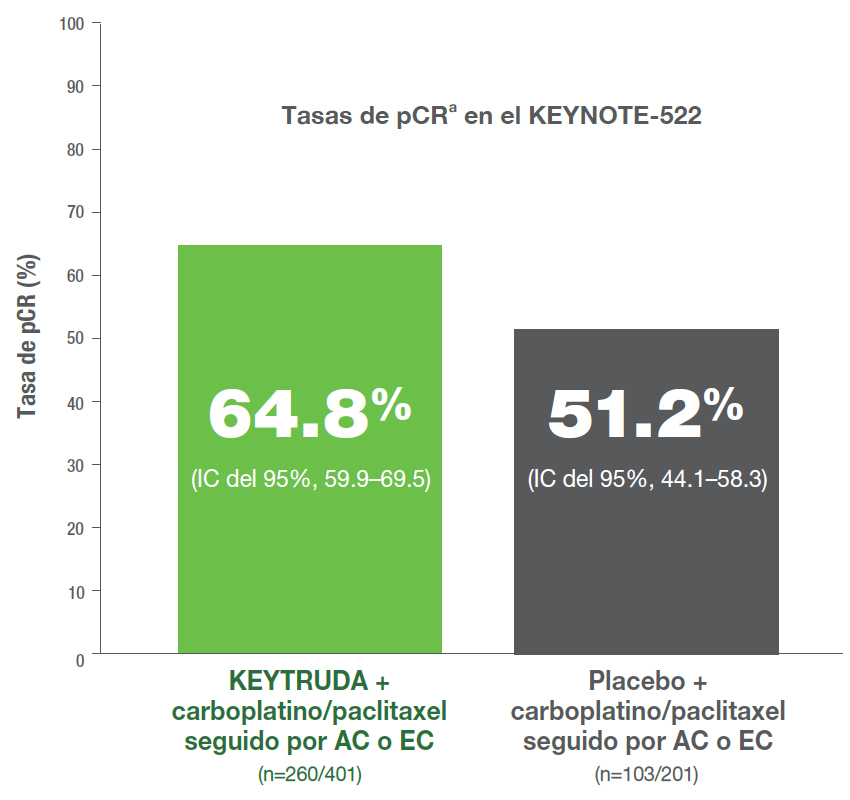
- 64.8% (IC del 95%, 59.9–69.5) de pacientes (260/401) tenían una respuesta patológica completad,e (pCR) en el grupo de KEYTRUDA + quimioterapiac vs. 51.2% (IC del 95%, 44.1–58.3) de pacientes (103/201) en el grupo de placebo + quimioterapiac.3
aLa supervivencia libre de eventos se definió como el momento desde la distribución al azar hasta la primera ocurrencia de cualquiera de los siguientes eventos: progresión de la enfermedad que impidiera la cirugía definitiva, recurrencia local o distante, segunda malignidad primaria, o muerte debida a cualquier causa.1,2
bBasado en un análisis de EFS intermedio previamente especificado (comparado con un nivel de significancia de 0.0052).1,2
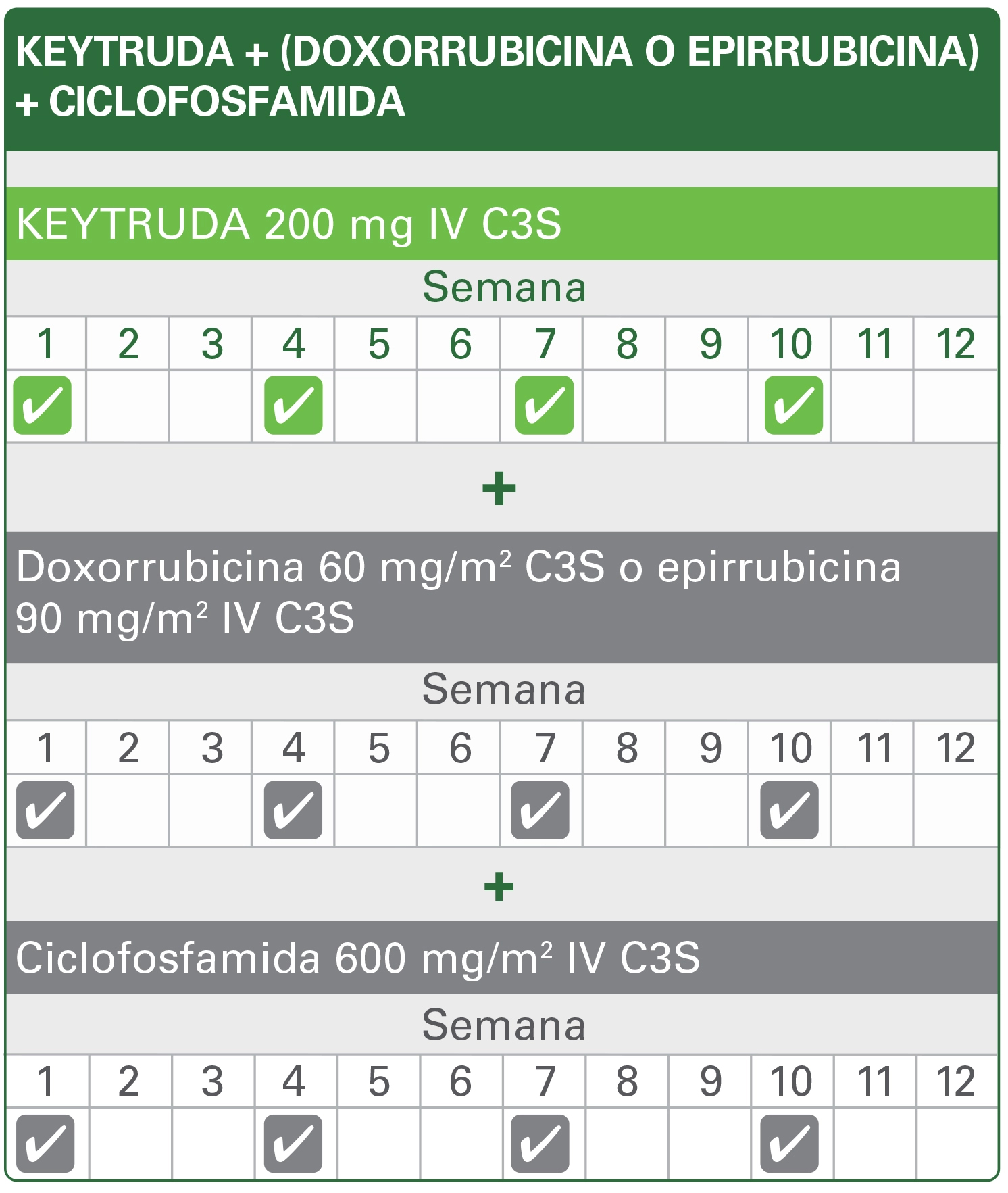
cQuimioterapia: carboplatino y paclitaxel seguidos por (doxorrubicina o epirrubicina) y ciclofosfamida.1
dLa pCR se definió como la ausencia de cáncer invasivo en la mama y los ganglios linfáticos (ypT0/Tis ypN0) y fue evaluada por el patólogo local de forma ciega al momento de la cirugía definitiva.1,2
eBasado en un análisis de pCR intermedio previamente especificado (en comparación con un nivel de significancia de 0.003).1,2

- En general, algunos pacientes con TNBC tienen peores resultados debido a la recurrencia a pesar de sus tratamientos iniciales.4-6

Un estudio distribuido al azar, multicéntrico, doble ciego, controlado con placebo realizado en 1,174 pacientes con TNBC en estadio temprano de alto riesgo, recién diagnosticado y sin tratamiento previo.¹
Criterios clave de inclusión¹
- TNBC en estadio temprano de alto riesgo recién diagnosticado y sin tratamiento previo.
- Tamaño del tumor >1 cm pero ≤2 cm de diámetro con compromiso ganglionar o tamaño del tumor >2 cm de diámetro independientemente del compromiso ganglionar.
- Inscrito independientemente de la expresión dePD-L1 del tumor.
- Enfermedad autoinmune activa que requirió tratamiento sistémico dentro de los 2 años de tratamiento.
- Problema de salud que requirió de inmunosupresión.
PD-L1= ligando 1 de muerte programada
Brazos del estudio
- Los pacientes (N=1174) fueron distribuidos al azar en una proporción de 2:1 a los siguientes brazos de tratamiento.1,a,b
KEYTRUDA (n=784)

PLACEBO (n=390)

Principales resultados de eficacia¹
- pCR: Ausencia de cáncer invasivo en mama y ganglios linfáticos (ypT0/Tis ypN0) y fue evaluada por el patólogo local de forma ciega en el momento de la cirugía definitiva.
- EFS: El momento desde la distribución al azar hasta la primera ocurrencia de cualquiera de los siguientes eventos: progresión de la enfermedad que impidiera la cirugía, recurrencia local o distante, segunda malignidad primaria o muerte por cualquier causa.
Resultado de eficacia adicional¹
- Supervivencia global (OS)
-Al momento del análisis de EFS, los resultados de OS aún no estaban maduros (45% de los eventos requeridos para el análisis final).
-El tratamiento con KEYTRUDA o placebo continuó hasta el término del tratamiento (17 ciclos), progresión de la enfermedad que impidiera la cirugía definitiva, recurrencia de la enfermedad en la fase adyuvante o toxicidad inaceptable.
aLa distribución al azar se estratificó según el compromiso ganglionar (positivo vs. negativo), el tamaño del tumor (T1/T2 vs. T3/T4) y la elección del carboplatino (dosis cada 3 semanas vs. semanal).
bTodos los medicamentos del estudio se administraron por vía intravenosa.
C3S= cada 3 semanas; AUC= área bajo la curva.


- En el KEYNOTE-522, se utilizaron quimioterapiaa, inmunoterapia y cirugía en el enfoque del tratamiento.¹
- KEYTRUDA + quimioterapiaa es un tratamiento combinado anti-PD-1 indicado para TNBC en estadio temprano de alto riesgo.1, 7-9
- KEYTRUDA y quimioterapiaa tienen dos mecanismos de acción independientes: mientras que KEYTRUDA ayuda a reactivar la inmunidad antitumoral, la quimioterapiaa ejerce sus efectos citotóxicos sobre las propias células tumorales.1, 10
aQuimioterapia: carboplatino y paclitaxel seguidos de (doxorrubicina o epirrubicina) y ciclofosfamida.

- En el KEYNOTE-522, 75% de los pacientes tenían enfermedad en estadio II, 25% tenían enfermedad en estadio III.
- Mediana de edad: 49 años (intervalo: 22–80).
- 87% tenían ECOG PS de 0; 13% tenían ECOG PS de 1.
- 56% tenían estado de premenopausia; 44% tenían estado de posmenopausia.
- 7% tenían Tumor 1 primario (T1), 68% T2, 19% T3 y 7% T4.
- 49% tenían compromiso ganglionar 0 (N0), 40% N1, 11% N2 y 0.2% N3.
Compromiso ganglionar y tamaño del tumor¹
En el KEYNOTE-522, los pacientes fueron elegibles si tenían un tamaño del tumor >1 cm pero ≤2 cm de diámetro con compromiso ganglionar o, tamaño del tumor>2 cm de diámetro independientemente del compromiso ganglionar.

ECOG PS= Estado Funcional según el Grupo Oncológico Cooperativo del Este; N-= ganglio negativo; N+= ganglio positivo

Estimados Kaplan-Meier de EFSa en el KEYNOTE-5221,2
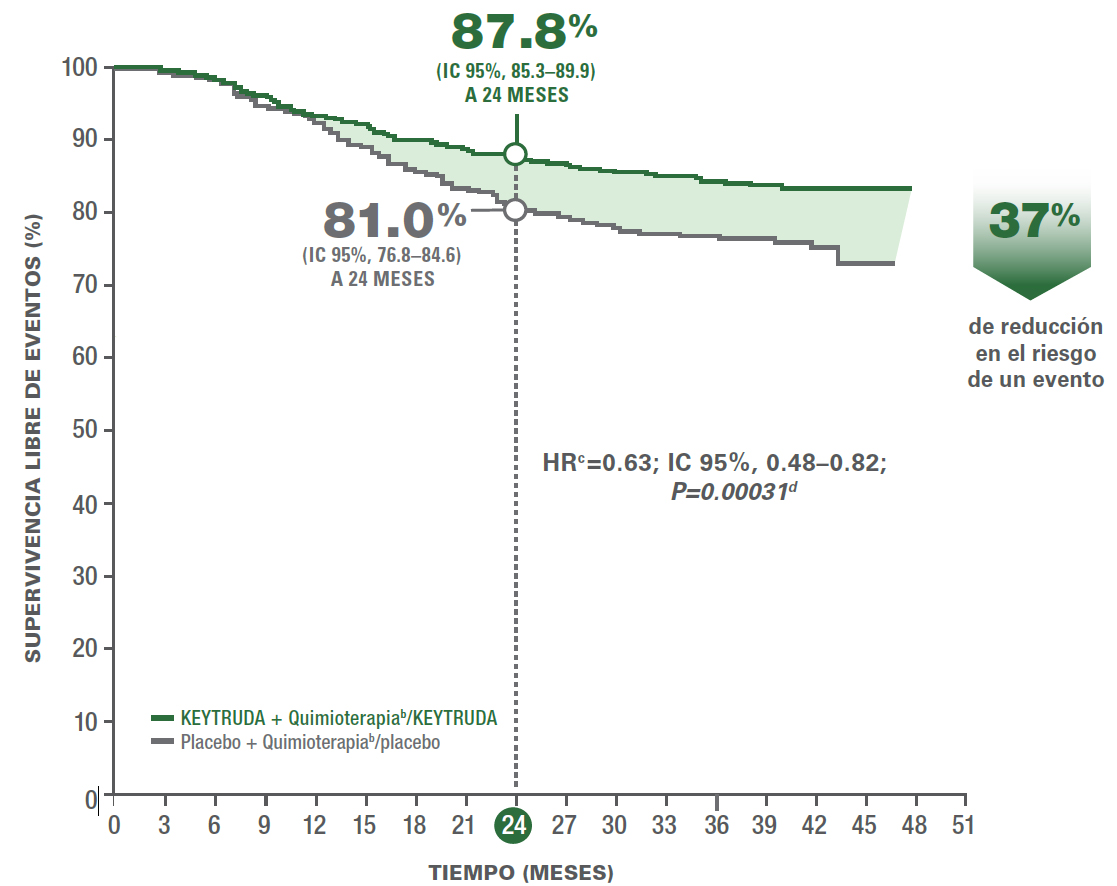

El número de pacientes con un evento fue 123/784 (16%) con KEYTRUDA + quimioterapiab/KEYTRUDA vs. 93/390 (24%) con placebo + quimioterapiab/placebo (HR=0.63; IC del 95%, 0.48–0.82; P=0.00031).1
El número de pacientes con un evento fue 123/784 (15.7%) con KEYTRUDA + quimioterapiab/KEYTRUDA vs. 93/390 (23.8%) con placebo + quimioterapiab/placebo (HR=0.63; IC del 95%, 0.48 – 0.82; P<0.001).2
- En un análisis interino preespecificado, la mediana del tiempo de seguimiento para los 784 pacientes tratados con KEYTRUDA fue de 37.8 meses (intervalo: 2.7–48 meses).¹
- En pacientes con TNBC en estadio temprano de alto riesgo, el tratamiento con KEYTRUDA + quimioterapiab neoadyuvante, seguido de KEYTRUDA adyuvante después de la cirugía, resultó en una supervivencia libre de eventos significativamente más prolongada que el tratamiento con placebo + quimioterapiab neoadyuvante, seguido de placebo después de la cirugía.1,2
aBasado en un análisis interino de EFS preespecificado (en comparación con un nivel de significancia de 0.0052).
bQuimioterapia: carboplatino y paclitaxel seguidos de (doxorrubicina o epirrubicina) y ciclofosfamida.
cBasado en el modelo de regresión de Cox con el método de Efron para el tratamiento de sucesos simultáneos como una covariable estratificada por el estado de los ganglios, el tamaño del tumor y la elección de carboplatino.
dBasado en la prueba estratificada de orden logarítmico por estado ganglionar, tamaño del tumor y elección de carboplatino.
New England Journal of Medicine, P Schmid, J Cortes, R Dent y cols., Event-Free Survival with Pembrolizumab in Early Triple-Negative Breast Cancer, 385:556-67, D.R. © 2022, Sociedad Médica de Massachusetts. Reimpreso con permiso de la Sociedad Médica de Massachusetts.
Mejora estadísticamente significativa en las tasas de pCRa para KEYTRUDA + quimioterapiab vs. placebo + quimioterapiab al momento de la cirugía definitiva en el KEYNOTE-5221,3
AC= doxorrubicina + ciclofosfamida; EC= epirrubicina + ciclofosfamida
- 13.6% más pacientesc alcanzaron pCRa con el régimen KEYTRUDA + quimioterapiab vs. régimen placebo + quimioterapiab (IC del 95%, 5.4–21.8; P=0.00055).1
- 13.6% más pacientesc alcanzaron pCRa con el régimen KEYTRUDA + quimioterapiab vs. régimen placebo + quimioterapiab (IC del 95%, 5.4–21.8; P<0.001).3
- En un análisis interino preespecificado, la mediana del tiempo de seguimiento para 784 pacientes tratados con KEYTRUDA fue de 37.8 meses (intervalo: 2.7–48 meses).1
aBasado en un análisis interino de pCR preespecificado (en comparación con un nivel de significancia de 0.003).
bQuimioterapia: carboplatino y paclitaxel seguidos de (doxorrubicina o epirrubicina) y ciclofosfamida.
cBasado en el método de Miettinen y Nurminen estratificado por estado ganglionar, tamaño del tumor y elección de carboplatino.


Nombre del paciente*
Mujer de 49 años
Sin antecedentes familiares relevantes; sin antecedentes de cáncer de mama previo
Presentación inicial8
- Se quejó de un bulto indoloro en el seno izquierdo.
- IMC 29 kg/m².
- Premenopáusica; sin antecedentes familiares de cáncer de mama.
DIAGNÓSTICO: Pronóstico clínico, TNBC en estadio IIB
Evaluación12
Examen físico: masa palpable en mama izquierda
Mamografía bilateral diagnóstica: lesión de masa espiculada de 2.1 cm en cuadrante superior externo de mama izquierda correspondiente a lesión de masa palpable
Ultrasonido: lesión de masa sólida irregular de 2.1 cm correspondiente a anomalía mamográfica; no se observan ganglios linfáticos axilares sospechosos
Biopsia tumoral con aguja gruesa: carcinoma ductal invasivo grado 3
Resultados de biomarcadores: ER/PR-negativo; HER2 negativo
PET/CT: negativo para metástasis a distancia
Panel multigénico: sin mutaciones deletéreas
ECOG PS: 0
IMC= índice de masa corporal; ER= receptor de estrógeno; PR= receptor de progesterona; HER2= receptor 2 del factor de crecimiento
epidérmico humano, PET= tomografía por emisión de positrones, CT= tomografía computarizada.

Neoadyuvante (ciclos 1–4)1,2
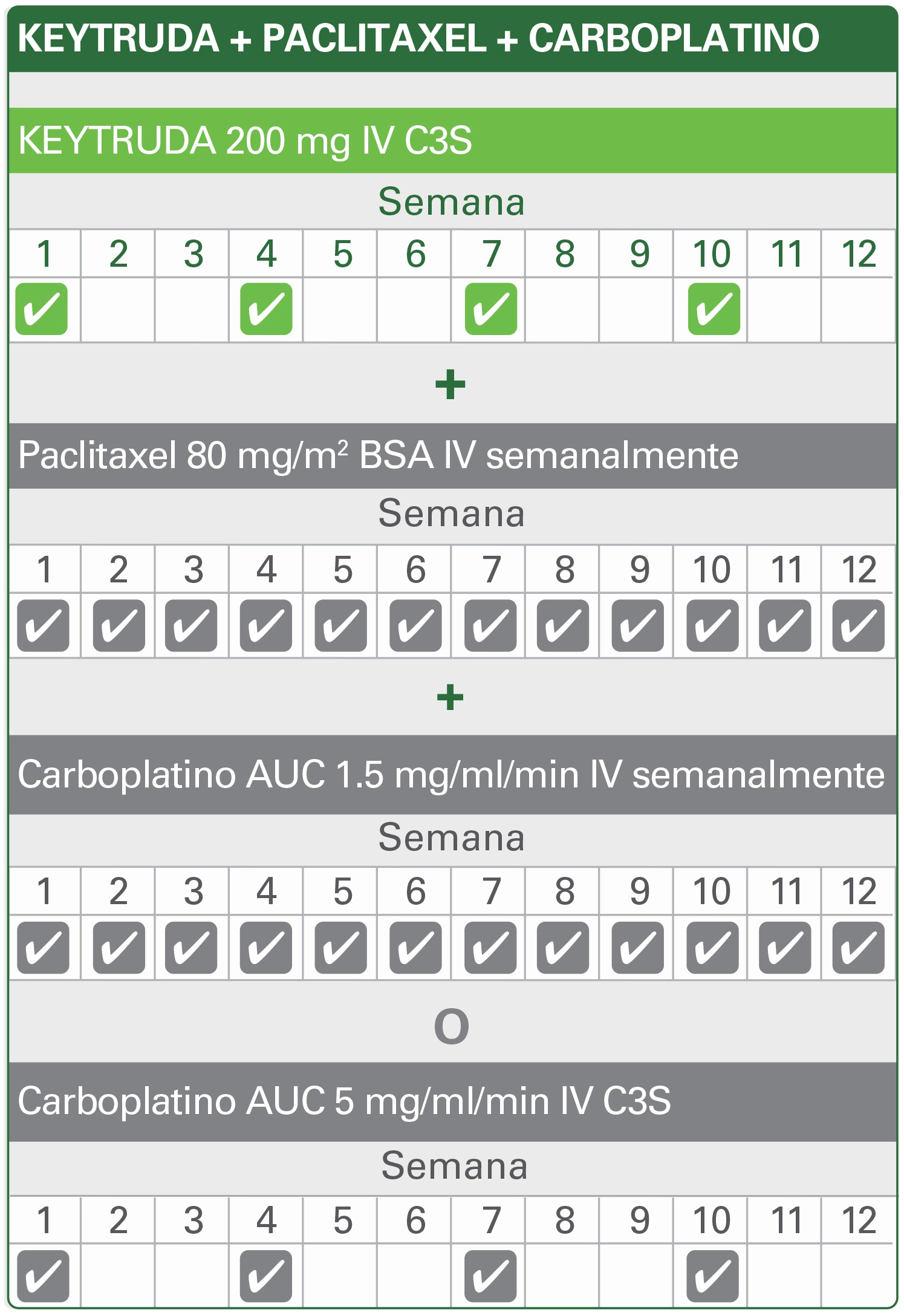
Neoadyuvante (ciclos 5–8)1,2
CIRUGÍA
Adyuvante (después de cirugía, 9 ciclos)1,2

La dosis recomendada de KEYTRUDA en adultos es 200 mg C3S o 400 C6S¹
KEYTRUDA se administra como una infusión intravenosa durante 30 minutos. Cuando se administre KEYTRUDA como parte de una combinación con quimioterapia intravenosa, se debe administrar primero KEYTRUDA. Para el tratamiento neoadyuvante y adyuvante del TNBC en estadio temprano de alto riesgo, los pacientes deben ser tratados con KEYTRUDA neoadyuvante en combinación con quimioterapiaa por 8 dosis de 200 mg cada 3 semanas o 4 dosis de 400 mg cada 6 semanas o hasta progresión de la enfermedad que imposibilite el tratamiento definitivo, cirugía o toxicidad inaceptable, seguido de tratamiento adyuvante con KEYTRUDA como monoterapia por 9 dosis de 200 mg cada 3 semanas o 5 dosis de 400 mg cada 6 semanas o hasta recurrencia de la enfermedad o toxicidad inaceptable. Los pacientes que experimenten progresión de la enfermedad que impida la cirugía definitiva o toxicidad inaceptable relacionada con KEYTRUDA como tratamiento neoadyuvante en combinación con quimioterapiaa no deben recibir KEYTRUDA como monoterapia como tratamiento adyuvante.
No se recomiendan reducciones de dosis de KEYTRUDA. Suspenda o interrumpa KEYTRUDA para controlar las reacciones adversas de moderadas a graves según las recomendaciones en la información para prescribir del producto.
IV= intravenoso; C3S= cada 3 semanas; AUC= área bajo la curva; C6S= cada 6 semanas; BSA= área de superficie corporal
Elija un enfoque multimodal para sus pacientes adecuados con TNBC en estadio temprano de alto riesgo que incluya KEYTRUDA+ quimioterapia neoadyuvantea, seguida de cirugía y luego monoterapia con KEYTRUDA adyuvante.
Reúnase con su equipo multidisciplinario para determinar si KEYTRUDA podría ser parte de una opción de tratamiento para sus pacientes con TNBC en estadio temprano de alto riesgo.1,2,13
aQuimioterapia: carboplatino y paclitaxel seguido de (doxorrubicina o epirrubicina) y ciclofosfamida.
Cáncer de mama triple negativo
KEYNOTE-522: Estudio controlado de tratamiento neoadyuvante y adyuvante de pacientes con TNBC en estadio temprano de alto riesgo.
En pacientes con TNBC en estadio temprano de alto riesgo que recibieron KEYTRUDA® en combinación con quimioterapia (carboplatino y paclitaxel seguido por doxorrubicina o epirrubicina y ciclofosfamida), administrado como un tratamiento neoadyuvante y continuado como tratamiento adyuvante en monoterapia, las reacciones adversas que ocurrieron en al menos el 20% de pacientes y con una incidencia más alta (diferencia ≥5%) en comparación con pacientes con TNBC que recibieron placebo en combinación con quimioterapia (carboplatino y paclitaxel seguido por doxorrubicina o epirrubicina y ciclofosfamida), administrado como un tratamiento neoadyuvante y continuado solo como tratamiento adyuvante fueron diarrea (41% vs. 34%), erupción cutánea (30% vs. 24%), pirexia (28% vs. 19%), y disminución del apetito (23% vs. 17%). De estas reacciones adversas, los eventos Grado 3-4 fueron diarrea (3.2% vs. 1.8%), erupción cutánea (1.8% vs. 0.3%), pirexia (1.3% vs. 0.3%) y disminución del apetito (0.9% vs. 0.3%).
Referencias:
- Información para prescribir de KEYTRUDA.
- Schmid P, Cortes J, Dent R y cols. Eventfree survival with pembrolizumab in early triple-negative breast cancer. N Engl J Med. 2022; 386(6):556-567. Doi:10.1056/nejmoa2112651
- Schmid P, Cortes J, Pusztai L y cols. Pembrolizumab for early triplenegative breast cancer. N Engl J Med. 2020; 382 (9):810-821. Doi:10.1056/nejmoa1910549.
- Gupta Gk, Collier AL, Lee D, y cols. Perspectives on triple-negative breast cancer: current treatment strategies,unmet needs, and potential targets for future therapies. Cancers (Basel). 2020;12(9):2392. Doi:10.3390/cancers12092392.
- Stuart-Harris R, Dahlstrom J, Gupta R, y cols. Recurrence in early breast cancer: analysis of data from 3,765 Australian women treated between 1997 and 2015. Breast. 2019;44:153–159. Doi:10.1016/j.breast.2019.02.044.
- Newton EE, Mueller LE, Treadwell SM, y cols. Molecular targetsof triple-negative breast cancer: where do we stand? Cancers (Basel). 2022;14(3):482. Doi:10.3390/cancers14030482.
- Opdivo [SmPC]. Dublin, Ireland: Bristol-Myers Squibb Pharma EEIG; 2022.
- Libtayo [SmPC]. Dublin, Irlanda: Regeneron Ireland Designated Activity Company (DAC); 2022.
- Jemperli [SmPC]. Dublin, Ireland: GlaxoSmithKline (Ireland) Limited; 2022.
- National Cancer Institute. Chemotherapy. Dictionary of Cancer Terms. https://www.cancer.gov/publications/dictionaries/cancerterms/def/chemotherapy. Consultado el 12 de abril de 2022.
- American Cancer Society. Breast cancer signs and symptons. https://www.cancer.org/cancer/breast-cancer/screening-tests-and-early-detection/breast-cancer-sign-and-symptons.html. Actualizado el 14 de enero de 2022. Consultado el 9 de febrerode 2022.
- Referenciado con autorización de la Guía en Prácticas Clínicas en Oncología de la NCCN(NCCN Guidelines©) para el cáncer de mama V4.2022. ©National Comprehensive Cancer Network, Inc.
- Yang X, Huang J, Zhu X y cols. Compliance with multidisciplinary team recommendations and disease outcomes in early breast cancer patients: an analysis of 4501 consecutive patients. Breast. 202;52:135–145. NCCN no ofrece garantía de ningún tipo con respecto a su contenido, uso o aplicación y se exime de cualquier responsabilidad por su aplicación o uso de cualquier manera.
Consulte la información Seleccionada de Seguridad completa aquí.
Antes de prescribir KEYTRUDA consulte la información para prescribir completa aquí.